Usos y calidad del agua, la eficiencia que mantiene los oasis mendocinos
- 4 - Usos y calidad del agua, la eficiencia que mantiene los oasis mendocinos
- 4.1 - Usos del agua en Mendoza
- 4.1.1 - Usos consuntivos y no consuntivos
- 4.1.2 - Demandas de uso
- 4.1.3 - Usos prioritarios
- 4.1.3.1 - Uso poblacional
- 4.1.3.2 - Usos del agua relacionados con la actividad productiva
- 4.1.3.2.1 - Uso del agua en agricultura. Sistemas de riego
- 4.1.3.2.2 - Actividades productivas por cuenca en zonas irrigadas
- 4.1.3.2.2.1 - Actividades productivas en la cuenca del río Mendoza
- 4.1.3.2.2.2 - Actividades productivas en la cuenca del río Tunuyán en su tramo Superior
- 4.1.3.2.2.3 - Actividades productivas en la cuenca del río Tunuyán en su tramo Inferior
- 4.1.3.2.2.4 - Actividades productivas en la cuenca del río Diamante
- 4.1.3.2.2.5 - Actividades productivas en la cuenca del río Atuel
- 4.1.3.2.2.6 - Actividades productivas en la cuenca del río Malargüe
- 4.2 - Calidad del agua
- 4.2.1 - La química del agua
- 4.2.2 - Composición del agua en la naturaleza
- 4.2.3 - Concepto de calidad del agua
- 4.2.4 - Calidad del agua y los diferentes usos
- 4.2.5 - El agua y la contaminación
- 4.2.6 - Preservación de la calidad del recurso hídrico
- 4.3 - Reúso de efluentes industriales y domésticos
- 4.1 - Usos del agua en Mendoza
La química del agua
El agua es un compuesto (H2O) que en condiciones normales (20°C y 1 atm) se encuentra en estado líquido. Su estructura molecular es simple: contiene dos átomos de hidrógeno (H) y uno de oxígeno (O). Cada átomo de hidrógeno está unido al oxígeno por medio de un par de electrones de enlace. El oxígeno tiene además, dos pares de electrones no enlazantes. De esta manera existen cuatro pares de electrones rodeando al átomo de oxígeno: dos pares formando parte de los enlaces covalentes con los átomos de hidrógeno y dos pares no compartidos en el lado opuesto.
Figura 118: Estructura molecular del agua 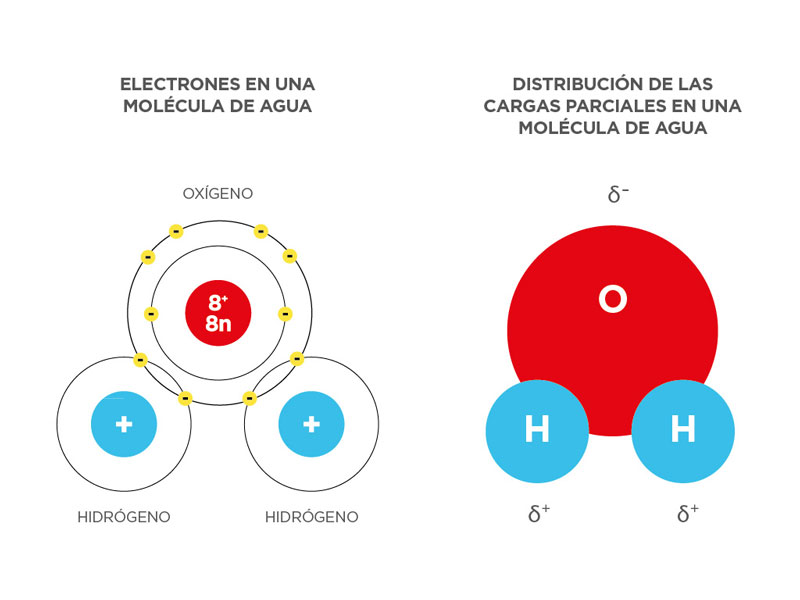
Fuente: Banco de imágenes del Departamento General de Irrigación.
Debido a que el ángulo entre los enlaces del H es de 105° resulta una molécula dipolar, es decir, que existe en ella una distribución irregular de la densidad electrónica. Por esta razón, el agua posee una carga parcial negativa cerca del átomo de oxígeno y una carga parcial positiva cerca de los átomos de hidrógeno. Una atracción electrostática entre la carga parcial positiva cercana a los átomos de hidrógeno y la carga parcial negativa cercana al oxígeno, origina un enlace por puente de hidrógeno.
Esta es una de las causas principales de sus propiedades físicas y de su comportamiento químico. La habilidad de los iones y otras moléculas para disolverse en el agua se debe a la polaridad de ésta última.
Ejemplo de cómo el agua disuelve un grano de sal (ClNa):
Figura 119: Forma sólida de la sal (cristalina)
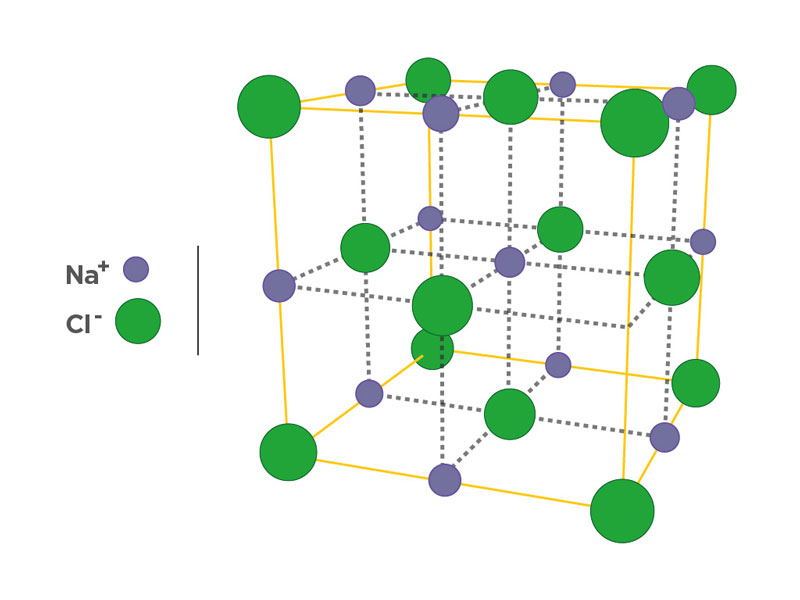
Fuente: Banco de imágenes del Departamento General de Irrigación.
Figura 120: Sal disuelta en agua
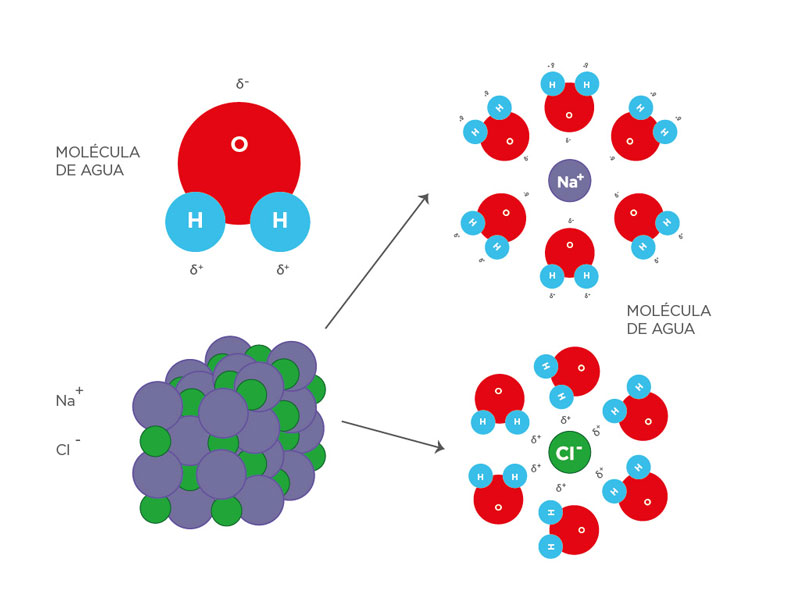
Fuente: Banco de imágenes del Departamento General de Irrigación.
Mapas
Más Información
Videos
Enlaces Externos
Bibliografía
Génova, Leopoldo (2011). Calidad del agua subterrá... DEIE Facultad de Ciencias Económicas UNCuyo (2011)... Abraham, Elena y otros (2006). Inventario y diagnó... Alvarez Amilcar y otros (2009). El agua en Mendoza... Rodríguez, Andrés (2009) Monitoreo Hidro-Ambiental... RALCEA (2013). Aprovechamiento y reúso de agua re... Rigoni, Claudio (2014). Taller de reúso agrícola.... FAO. (2004). Áreas de riego. Provincia de Mendoza.Glosario Ilustrativo Completo
- Abanico aluvial:
- Terreno o accidente geográfico formado, en general, a la salida de un cañón en una llanura plana. Esto se produce cuando una corriente de agua disminuye su velocidad y deposita los sedimentos de su cauce en forma de abanico. Sinónimos: cono aluvial, abanico detrítico.
- Abanico detrítico:
- Terreno o accidente geográfico formado, en general, a la salida de un cañón en una llanura plana. Esto se produce cuando una corriente de agua disminuye su velocidad y deposita los sedimentos de su cauce en forma de abanico. Sinónimos: abanico aluvial, cono aluvial.
- Abrevadero:
- Estanque o paraje del río, arroyo o manantial, por lo general para dar de beber al ganado.
- Acequia:
- Canalización de menor jerarquía, construida para transportar agua por gravedad.
- ACREs:
- Áreas de Cultivos Restringidos.
- Acuiclúdo:
- Formación geológica y/o sedimentaria que contiene agua pero que no la cede (ejemplo: arcillas) y se comporta como impermeable.
- Acuífero confinado:
- Depósito de aguas subterráneas, que se encuentra limitado superior e inferiormente por formaciones geológicas impermeables.
- Acuífero freático:
- Se trata de distintas profundidades de aguas subterráneas relacionados con la superficie del terreno, limitado inferiormente por un manto semi o impermeable. El agua almacenada se encuentra influenciada por la presión atmosférica. Sinónimos: acuífero libre, acuífero no confinado.
- Acuífero libre:
- Se trata de distintas profundidades de aguas subterráneas relacionados con la superficie del terreno, limitado inferiormente por un manto semi o impermeable. El agua almacenada se encuentra influenciada por la presión atmosférica. Sinónimos: acuífero freático, acuífero no confinado.
- Acuífero no confinado:
- Se trata de distintas profundidades de aguas subterráneas relacionados con la superficie del terreno, limitado inferiormente por un manto semi o impermeable. El agua almacenada se encuentra influenciada por la presión atmosférica. Sinónimos: acuífero libre, acuífero freático.
- Acuífero semi-confinado:
- Delimitado por una base acuícluda (o acuitarda) y un techo acuitardo. Se trata de un caso particular en acuíferos cautivos, en los que el techo es incompleto o no son totalmente impermeables, sino que permiten una vinculación vertical del agua.
- Acuífugo:
- Formaciones que no contienen ni permiten el movimiento de agua. Por ejemplo, granito masivo.
- Acuitardo:
- Estratos de baja permeabilidad, con capacidad para transmitir en forma lenta cierta cantidad de agua, a los estratos permeables ubicados arriba y/o abajo.
- Afluente:
- Curso de agua que desemboca en uno mayor o en un lago. Sinónimo: tributario.
- Aforo de caudal:
- Son las mediciones de caudales que recorren ríos y/o canales, en aquellos puntos o sectores de sección definida. Las mediciones se pueden hacer de una manera continua o permanente o de una manera puntual o instantánea.
- Agua biológica:
- Volumen de agua almacenada en los seres vivos.
- Aguas continentales:
- Refiere a las aguas quietas o corrientes que fluyen en la superficie del suelo y todas las aguas subterráneas en el ámbito continental.
- Aguas oceánicas:
- Masas de agua que conforman los océanos que representan el 97% del agua del planeta.
- ALC:
- América Latina y el Caribe.
- Alcalinidad:
- Capacidad de una solución para neutralizar un ácido, o la cantidad de ácido que se requiere por litro de agua, para disminuir el pH a un valor aproximado de 4.
- Alcohol metílico:
- Líquido incoloro, volátil, tóxico y soluble en agua. Se obtiene de la oxidación incompleta del gas natural o se puede producir sintéticamente a partir del monóxido de carbono e hidrogeno. Se utiliza como solvente, combustible, anticongelante para automóviles y en la síntesis de formaldehidos. Sinónimo de metanol.
- Aliviadero:
- Obra construida habitualmente en presas, sobre la cual vierte el exceso de agua de crecidas, que así es evacuada.
- Alud:
- Masa de nieve o hielo que se desprende bruscamente, descendiendo por la pendiente de una montaña y arrastra por lo general tierra, rocas y fragmentos.
- Alúminas:
- Sal derivada del óxido de aluminio, cuando éste actúa como un ácido.
- Anaerobiosis:
- Capacidad que poseen algunos organismos, como hongos, bacterias, parásitos, etc., para vivir sin oxígeno molecular libre. Sinónimo de vida en ausencia de oxígeno libre.
- Anegar:
- Inundar. Saturar con agua. En un solo anegado, la totalidad de los espacios vacíos, se encuentran llenos de agua.
- Anticiclón:
- Perturbación atmosférica que consiste en un área de altas presiones y circulación de viento en sentido de las agujas del reloj en el hemisferio Norte, e inversamente en el Sur.
- Antrópico:
- El prefijo “antropo” alude a humanidad. Antrópico es un adjetivo que significa relativo al hombre. Factores antrópicos en la actividad humana y riesgos antrópicos a la intervención de la misma.
- Áreas naturales protegidas:
- Áreas delimitadas como reservas, que proponen asegurar la preservación de especies, ambientes naturales y en algunos casos, sitios declarados como Patrimonio Cultural.
- Arsénico:
- Compuesto tóxico. Se encuentra de manera natural mayormente en aguas asociadas a sedimentos de origen volcánico y en el aire alrededor de ciertas fundidoras.
- Avifauna:
- Conjunto de las aves y la fauna de un país o región.
- AySAM:
- Aguas y Saneamiento de Mendoza.
- Azud:
- Palabra de origen árabe que significa 'barrera'. Es una construcción habitualmente realizada para elevar el nivel de un caudal o río, con el fin de derivar parte de dicho caudal a canales o acequias.
- Bañado:
- Terreno húmedo, sobresaturado, cenagoso y a veces inundado por aguas pluviales, de un río o laguna cercana. Además se genera por ascenso de nivel de las aguas freáticas.
- Barranca:
- Pendiente abrupta de una superficie llana hacia el lecho de un río, de un lago o de otra superficie llana.
- Basicidad:
- Medida cuantitativa de las propiedades de una base. En disoluciones diluidas, la basicidad aumenta para pH superiores a 7 y el máximo se da en pH 14. En disoluciones concentradas la basicidad se mide con la concentración de [OH-].
- Biodiversidad:
- Variedad de seres vivos: plantas, animales y microorganismos, existentes sobre la Tierra, desde los niveles genéticos hasta los ecosistemas que habitan. Forma la red vital de la cual somos parte integrante y de la cual dependemos.
- Boro:
- Elemento químico de símbolo Bo. Semimetal escaso en la corteza terrestre.
- BPA:
- Buenas Prácticas Agrícolas.
- BPM:
- Buenas Prácticas de Manufactura.
- Canto rodado:
- Fragmento de roca sin distinción de forma y clase de un tamaño de 64 y 256 mm; que puede ser transportado por ríos o torrente. Piedra alisada y redondeada a fuerza del transporte o rodamiento, producto de la erosión fluvial.
- Cauce aluvial:
- Cursos naturales de carácter torrencial. Se activan con tormentas de corto período de tiempo y pendientes pronunciadas, generando arrastre, avenidas de agua. piedras y barro.
- Caudal:
- Flujo de agua superficial en un río o en un canal. Cantidad de agua que discurre.
- Caudaloso:
- Corriente de agua que discurre a través de un río o canal, con volúmenes y velocidades destacados.
- CDB:
- Convenio sobre la Diversidad Biológica.
- CEPAL:
- Comisión Económica para América Latina y el Caribe.
- Ciclón:
- Perturbación atmosférica caracterizada por fuertes vientos, abundantes precipitaciones y, a veces, fenómenos eléctricos.
- Ciénaga:
- Área de tierra húmeda sobresaturada y localizada. Forma parte de los ecosistemas especiales (humedales). Sinónimos: marisma y pantano.
- COHIFE:
- Consejo Hídrico Federal.
- Coliforme:
- Grupo de especies bacterianas que tienen ciertas características bioquímicas en común e importancia relevante como indicadores de contaminación del agua y los alimentos.
- Colindar:
- Se dice de dos o más terrenos vecinos entre sí.
- Coloide:
- Sustancia que se dispersa lentamente en un líquido.
- Condensar:
- Es el proceso por el cual el vapor de agua del aire se transforma en agua líquida. La condensación es importante para el ciclo del agua, ya que forma las nubes.
- Congelar:
- El punto de congelación es el momento en el cual un líquido se solidifica (pasa del estado líquido al sólido). En el caso del agua pura, el punto de congelación es 0 °C.
- Cono aluvial:
- Terreno o accidente geográfico formado, en general, a la salida de un cañón en una llanura plana. Esto se produce cuando una corriente de agua disminuye su velocidad y deposita los sedimentos de su cauce en forma de abanico. Sinónimos: abanico aluvial, abanico detrítico.
- Consumo de agua endosomático:
- Consumo necesario para sobrevivir, es decir, a aquella cantidad de agua que nos hace falta al realizar nuestras funciones vitales.
- Consumo exosomático:
- Corresponde a los usos prescindibles desde el punto de vista biológico, relacionados con factores culturales y sociales.
- Convección:
- Movimientos internos organizados dentro de una capa de aire, permitiendo el transporte vertical del calor. Proceso de transferencia de calor en fluidos.
- Convención de Ramsar:
- Convención sobre los Humedales. Se refiere a los humedales de Importancia Internacional, especialmente como hábitat de aves acuáticas.
- Cota:
- Número que en los planos topográficos indica la altura de un punto sobre el nivel del mar. Representa la altura a partir de la cota 0, de acuerdo al nivel del mar. Se simboliza en metros (Ej.: 350 m.s.n.m.-350 metros sobre nivel del mar). Se utiliza para medir el nivel de la masa de agua en un cauce, embalse u otro similar.
- Cresta:
- Porción más elevada, o cima, cuya configuración puede imaginársela limitada por dos planos que se intersectan en una línea.
- Cubeta sedimentaria:
- Forma deprimida y cerrada del terreno, que contiene depósitos de sólidos en suspensión y elementos químicos disueltos en el agua por decantación y precipitación.
- Cuenca administrativa:
- Espacio físico encargado de la gestión y administración del agua.
- Cuenca arreica:
- Área que carece de cursos de agua, o en las que es difícil determinar la divisoria de agua, debido a su lento escurrimiento o infiltración.
- Cuenca de recolección:
- Nacimiento o parte superior de una red hidrográfica que colecta agua hacia un punto más bajo.
- Cuenca endorreica:
- Área en la que el agua no tiene salida fluvial ni al mar ni al océano. Las lluvias o precipitaciones que caen en una cuenca endorreica, permanecen allí, abandonando el sistema únicamente por infiltración o evaporación.
- Cuenca hidrográfica:
- Territorio drenado por un único sistema de escurrimiento natural, es decir, que drena sus aguas al mar a través de un único río, o que vierte sus aguas a un único lago endorreico. Sinónimo: cuenca imbrífera.
- Cuenca Imbrífera:
- Territorio drenado por un único sistema de escurrimiento natural, es decir, que drena sus aguas al mar a través de un único río, o que vierte sus aguas a un único lago endorreico. Sinónimo: cuenca hidrográfica.
- Damero:
- Diseño de un plano urbano que organiza la ciudad mediante calles en ángulo recto, creando manzanas cuadradas (cuadras).
- Decantar:
- Separar mezclas heterogéneas, que pueden estar conformadas por una sustancia líquida y una sólida, o por dos sustancias líquidas. Colocarse una de las sustancias en la base de la otra, por efecto de sus distintas densidades, lo que permite separarlas. Sinónimo: sedimentar.
- Delta:
- Conjunto geográfico y geomorfológico formado por depósitos aluviales en la desembocadura de un río.
- Depósito aluvial:
- Material depositado por un flujo de agua, compuesto generalmente por arcilla, limo, arena, grava, etc.
- Deposito de rocío:
- Es el volumen de agua acumulada producto de la condensación.
- Depósitos eólicos:
- Acumulaciones de arena por acción de los vientos, en forma de médanos o dunas.
- Desbaste:
- Operación en la que se separan, de las aguas residuales, los cuerpos de mayor tamaño flotantes o en suspensión.
- Desecación:
- Proceso de secado de un suelo o sedimento en el que se extrae el agua capilar de forma completa o casi completa por tensión superficial.
- Desertificación:
- Proceso por el que terrenos áridos o semiáridos se transforman progresivamente en desérticos, debido a la continua falta de precipitación y a la inadecuada gestión del suelo.
- Desfiladero:
- Paso estrecho entre montañas.
- DGI:
- Departamento General de Irrigación.
- Dilución:
- Mezcla homogénea, uniforme y estable, formada por dos o más sustancias denominadas componentes; como resultado del efecto de disolver.
- Discurrir:
- Escorrentía de superficie.
- Disentería:
- Enfermedad infecciosa y específica que tiene por síntomas característicos la diarrea con pujos y alguna mezcla de sangre, comúnmente producida por la ingesta de agua contaminada.
- Duna:
- Forma del terreno producida por la evolución de la costa (duna costera) o por la evolución.
- EAN:
- Equivalente Agua Nieve.
- Ecosistema:
- Conjunto dinámico de animales, vegetales y comunidades de microorganismos que se interrelacionan entre sí y con su entorno en una unión funcional.
- Edafología:
- Ciencia que estudia las propiedades del suelo.
- Emanación:
- Proceso donde las substancias volátiles se desprenden de los cuerpos.
- Enclave:
- Territorio incluido en otro con diferentes características políticas, administrativas, geográficas, etc.
- EPAS:
- Ente Provincial del Agua y de Saneamiento.
- Erogar:
- Distribuir, repartir bienes o caudales.
- Erosión:
- Desgaste de la superficie terrestre por agentes externos, como agua, hielo, viento y olas.
- Escorrentía:
- Parte de la precipitación que fluye por la superficie del terreno hacia un cauce superficial o cuerpo de agua.
- Escurrimiento sub-superficial:
- Es la precipitación que llega a infiltrarse en el suelo y circula lateralmente a pequeñas profundidades, sin llegar a la zona saturada y reaparece en superficie, incorporándose al escurrimiento superficial.
- Escurrimiento subterráneo:
- Es la movilidad del agua almacenada en los acuíferos entre los sedimentos del mismo.
- Escurrimiento superficial:
- Es el proceso por el cual el agua de lluvia precipitada en la superficie de la tierra fluye por acción de la gravedad desde las partes más altas hacia las más bajas, confluyendo en ríos, arroyos y otros cuerpos de agua. Ídem. Escorrentía.
- Estero:
- Río pequeño o arroyo. En la zona austral se usa como sinónimo de estuario o entrada o brazo de mar.
- Estuario:
- Parte ancha de un curso de agua en las proximidades de su desembocadura al mar, a un lago o a una salada. Geoforma de origen marino o lagunar.
- Eutroficación:
- Enriquecimiento del agua por nutrientes, especialmente compuestos de nitrógeno y fosforo, de manera que la descomposición del exceso de materia orgánica produce una disminución del oxigeno en las aguas profundas.
- EUWI:
- Unión Europea para el Agua.
- Evaporación:
- Es el proceso por el cual el agua de la superficie terrestre pasa del estado líquido al vapor, siendo la energía solar el principal factor desencadenante del proceso.
- Evaporita:
- Roca sedimentaria o mineral que se origina por procesos de evaporación. Ej.: sal, yeso.
- Evapotranspiración:
- Es el agua evaporada a partir de la cantidad de humedad del suelo y transpiradas en el proceso de desarrollo de las plantas.
- Faldeo:
- Parte baja de los montes o sierras.
- FAO:
- Organización de Naciones Unidas para la Alimentación y la agricultura.
- Fenoles:
- Derivado alcohólico del benceno, es un sólido incoloro que funde a 41ºC. Posee un olor característico y es muy venenoso. Se utiliza como antiséptico, desinfectante y germicida.
- Fisiográfico:
- Formas cuyo modelado es el resultado de la acción dinámica de diversos agentes y fenómenos que han actuado sobre el medio físico. Suele ser expresado por la interacción de factores tectónicos, orogénicos, litológicos y por procesos erosivos y deposicionales.
- Fluvial:
- Término general que denota el flujo de un curso de agua. Corriente de agua que drena una cuenca de forma natural.
- Freático:
- Primer nivel de almacenamiento de aguas subterráneas, también conocido como acuífero libre.
- Funguicida:
- Productos químicos que eliminan los hongos.
- Gavión:
- Cajas rectangulares o prismáticas de malla hexagonal, rellenas con piedras. Se construyen como obras de corrección y control de erosión en cauces torrenciales y estabilidad de taludes.
- Geohidrología:
- Estudia el origen, localización, movimiento y características de las aguas subterráneas, con especial énfasis en los aspectos geológicos. Sinónimo: hidrogeología.
- Geomorfología:
- Ciencia que estudia el origen y desarrollo del relieve de la corteza terrestre.
- Geosinclinal:
- Gran depresión en la que se acumulan miles de sedimentos.
- GIRH:
- Gestión Integrada de los Recursos Hídricos.
- Glaciar:
- Masa de hielo acumulada en las zonas cordilleranas, por encima del límite de las nieves perpetuas.
- Grava:
- Conjunto de piedras lisas y pequeñas. Tiene mayor tamaño que el guijo (2 a 6 mm.); es decir es mas chico que el canto. Grano rocoso compacto, frecuentemente utilizado como sinónimo de gravilla.
- Guijarro:
- Fragmento rocoso, con un diámetro comprendido entre 6 y 64 mm.; mayor que la grava o gravilla y menor que un canto.
- GWP:
- Global Water Partnetship.
- Halófila:
- Planta que vive en terrenos donde abundan las sales.
- HH:
- Huella Hídrica.
- Hibernación:
- Estado fisiológico que se presenta en ciertos mamíferos como adaptación a condiciones invernales extremas, con descenso de la temperatura corporal hasta cerca de 0° y disminución general de las funciones metabólicas.
- Hidrogeología:
- Estudia el origen, localización, movimiento y características de las aguas subterráneas, con especial énfasis en los aspectos geológicos. Sinónimo: geohidrología.
- Infiltración:
- Es el agua de precipitación que en su descenso a la superficie, ocupa parcial o totalmente los poros o fisuras del suelo y rocas.
- IPBES:
- Plataforma intergubernamental científico-normativa sobre diversidad biológica y servicios de ecosistemas.
- IPH:
- Índice de Pobreza Hídrica.
- ISCAMEN:
- Instituto de Sanidad y Calidad Agropecuaria Mendoza.
- Islote:
- Isla pequeña y despoblada.
- Lacunar:
- Agua u otro sustancia líquida, detenida en un hoyo o cavidad de la tierra o del piso.
- Lacustres:
- Perteneciente o relativo a los lagos.
- Lagar:
- En hidrología: masa de agua cerrada que posee depósitos de turba en el fondo, compuesto en gran parte de materia vegetal. Sinónimo: lago bog.
- Lago bog:
- En hidrología: masa de agua cerrada que posee depósitos de turba en el fondo, compuesto en gran parte de materia vegetal. Sinónimo: lagar.
- Lecho del rio:
- Zona mas profunda de un valle fluvial, donde el agua socava de acuerdo a la intensidad de flujo.
- Lentico:
- Dícese de aguas en calma o quietas.
- Litología:
- Descripción sistemática de las rocas y sus propiedades.
- Lixiviado:
- Solución producida por el flujo o la percolación de un líquido a través de un suelo o un residuo sólido, y la consiguiente disolución de ciertos constituyentes en el agua.
- Lixiviar:
- Acción de desplazamiento de materiales de la solución del suelo por un flujo líquido (por precolación del fluido). Proceso por el cual constituyentes solubles son disueltos y filtrados a través del suelo por la precolación del suelo.
- Lodazal:
- Sitios deprimidos de sedimentos finos e impermeables, saturados en agua. Generan ciénagas barriales o lodazales.
- Lodo biológico:
- Es una concentración de micro organismos, conocido también como lodo activado. Son utilizados en el tratamiento de las aguas residuales.
- MAB:
- Programa sobre el Hombre y la Biósfera.
- Mallín:
- Pradera cenagosa.
- Manglar:
- Bosques de plantas leñosas que se desarrollan en lagunas, riberas y en costas tropicales. Pertenecen a un tipo de humedales, en la categoría de pantanos de agua salada.
- Marisma:
- Área de tierra húmeda sobresaturada y localizada. Forma parte de los ecosistemas especiales (humedales). Sinónimos: ciénaga y pantano.
- Meandro:
- Porción curva de un cauce sinuoso, consistente en dos giros consecutivos, uno en la dirección de las agujas del reloj y otro al contrario.
- Médano:
- Montón de arena casi a flor de agua, en paraje donde el mar o la masa de agua tienen poco fondo.
- MIDO:
- Modelo de Indicadores de Distribución Operativa.
- Morfodinámica:
- Procesos externos o exógenos, que transforman el relieve mediante agentes como: hielo, viento y agua.
- Morfología:
- Descripción de las formas de relieve. El análisis morfológico lleva al inventario de las geoformas.
- Morfología de suelos:
- Características del suelo, como sus constituciones físicas; en especial, las propiedades estructurales de su perfil, manifestadas en el tipo, espesor, deposición de horizontes.
- Morfología fluvial:
- Ciencia que estudia la formación de diversas acumulaciones de sedimentos en los lechos, llanuras de inundación y cauces por la acción del agua.
- Mutagénicos:
- En biología, un mutágeno es un agente físico, químico o biológico que altera o cambia la información genética (usualmente ADN) de un organismo y ello incrementa la frecuencia de mutaciones por encima del nivel natural.
- Napa:
- Capa de agua en la superficie de la tierra, o subterránea.
- Nival:
- Cantidad de agua proveniente de la precipitación y/o fusión de la nieve.
- Nodo:
- Punto de interconexión y control de cauces dentro de la red de riego.
- ODM:
- Objetivos de Desarrollo del Milenio.
- Oligotrófico:
- Condición de una masa de agua que es pobre en nutrientes y contiene muchas especies de organismos acuáticos que están presentes en un número relativamente pequeño.
- OMS:
- Organización Mundial de la Salud.
- Ornitología:
- Parte de la zoología que trata de las aves.
- Orogénesis:
- Conjunto de fenómenos geológicos asociados a la evolución geosinclinal, mediante los cuales se generan las cadenas de montañas.
- Orografía:
- Parte de la geografía física que describe el relieve montañoso.
- ORSEP:
- Órgano Regulador de Seguridad de Presas.
- Ósmosis:
- Paso de un solvente de una solución diluida a otra más concentrada, a través de una membrana semipermeable; es decir permeable solo al solvente.
- Palustres:
- Perteneciente o relativo a una laguna o a un pantano.
- Pantano:
- Área de tierra húmeda sobresaturada y localizada. Forma parte de los ecosistemas especiales (humedales). Sinónimos: ciénaga y marisma.
- PBI:
- Producto Bruto Interno.
- Pedemontano:
- Adjetivo utilizado para las zonas del piedemonte.
- Pedimento:
- Superficie rocosa de escasa pendiente, que rodea las alineaciones montañosas desérticas y que frecuentemente queda cubierta por un depósito de material rocoso, gravas y arenas.
- Percolación:
- Circulación vertical de un liquido a través de la superficie del suelo por acción de la gravedad.
- Permeabilidad:
- Es la capacidad que tiene una roca de permitir el flujo de fluidos a través de sus poros interconectados. Si los poros de la roca no se encuentran interconectados no puede existir permeabilidad. Un material más permeable puede ceder agua (brindar mayor caudal) con mayor facilidad y velocidad que uno menos permeable.
- PH:
- Grado de acidez de una solución.
- PHI:
- Programa Hidrológico Internacional.
- Piedemonte:
- Del francés: pie de una montaña. Rampa suave que enlaza laderas de una montaña con una llanura y que incluye al pedimento, acumulación del material aluvial. Superficie marginal a las montañas, de las que se distingue por una pendiente y altura considerablemente menores. Tiene estructura y forma diversa constituido por sustrato rocoso o capas potentes de sedimento.
- Piezómetro:
- Instrumento que se utiliza para medir la presión de poros o nivel del agua en perforaciones, terraplenes, cañerías y estanques a presión. La aplicación geotécnica más común es para determinar la presión de agua en el terreno o el nivel de agua en perforaciones.
- Plantas hidrófitas:
- Plantas acuáticas. Todas aquellas plantas que viven en el agua, en suelo cubierto de agua o en suelo saturado de agua.
- Pluvial:
- Precipitación líquida procedente de la condensación o sublimación del vapor de agua que cae de las nubes o es depositada desde el aire en el suelo.
- PNUMA:
- Programa de Naciones Unidas para el Medio Ambiente.
- Porosidad:
- Desde el punto de vista cualitativo la porosidad es la capacidad de una roca de tener poros, entendiendo por poro cualquier espacio de una masa rocosa que no esté ocupado por un material sólido, sino por un fluido (agua, aire, petróleo). Cuantitativamente, la porosidad se define como el espacio total total ocupado por poros en un volumen determinado de roca.
- Pozo:
- Es una excavación o túnel vertical que perfora la tierra, hasta una profundidad suficiente para alcanzar una reserva de agua subterránea o fluidos como el petróleo.
- Pozo balde:
- De construcción artesanal de poca profundidad, que permite aprovechar el acuífero freático para consumo animal, riego y consumo humano. Se encuentra en puestos y caseríos de zonas rurales no irrigadas, donde la disponibilidad de agua superficial es prácticamente nula.
- Precipitación:
- Es la caída del agua en estado líquido o sólido sobre la superficie terrestre. Fuente principal de la formación de las aguas de la tierra, ríos, lagos, aguas subterráneas y glaciares.
- PROSAP:
- Programa de Servicios Agrícolas Provinciales.
- Prospección:
- Exploración del subsuelo basada en el examen de los caracteres del terreno y encaminada a descubrir yacimientos minerales, petrolíferos, aguas subterráneas, etc.
- Punto de rocío:
- Es la temperatura a la cual debe ser enfriado el aire, a presión y humedad constantes, para que ocurra la saturación.
- RALCEA:
- Red Latinoamericana de Centros de Excelencia en Agua.
- RBIH:
- Red Básica de Información Hídrica.
- Régimen termo-nival:
- Régimen: Término utilizado para caracterizar la distribución estacional de uno o más elementos hidrológicos en un lugar determinado. Nival: identifica a los ríos con características similares a los de régimen glaciar, pero que se diferencian por ser más irregulares en su variabilidad en el transcurso del año, cuando las temperaturas elevadas derriten la nieve acumulada.
- Resiliencia:
- Propiedad de un sistema hídrico para permanecer en estado de equilibrio, a pesar de las diversas perturbaciones ecológicas a las que puede estar sometido.
- Retracción:
- Reducción persistente de volumen.
- Ribereños:
- Relativo a la orilla de una masa de agua dulce.
- Rocío:
- Es el agua condensada sobre los cuerpos (flores, vidrio, pasto, metal, etc.) cerca de la superficie del suelo, como resultado de un enfriamiento por radiación.
- SAG:
- Sistema Acuífero Guaraní.
- Saneamiento:
- Obras o infraestructura urbanas y rurales que permite el tratamiento o alcantarillados, tratamiento de aguas, manejo y disposición de desechos líquidos y sólidos.
- Sedimentación:
- Proceso de depósito y asentamiento de la materia en suspensión en el agua por gravedad.
- Sedimentar:
- Separar mezclas heterogéneas, que pueden estar conformadas por una sustancia líquida y una sólida, o por dos sustancias líquidas. Colocarse una de las sustancias en la base de la otra, por efecto de sus distintas densidades, lo que permite separarlas. Sinónimo: decantar.
- Sifón:
- Estructuras hidráulicas que se utilizan en canales para conducir el agua a través de obstáculos, tales como: río, una depresión del terreno u otro canal.
- SIG:
- Sistemas de Información Geográfica.
- Sistemas orográficos positivos:
- Cadena de montañas o elevaciones que responden a un mismo patrón de formación. Ejemplos: Cordillera de los Andes, Alpes, Rocallosas, Sierra de Famatina, Precordillera de la Rioja, San Juan y Mendoza.
- Socavar:
- Acción erosiva del agua en un curso de agua que da lugar a la excavación y al transporte de materiales del lecho y de las márgenes.
- Sodificar:
- Proceso de aumentar el porcentaje de sodio en agua, lo que induce la dispersión de las arcillas y la materia orgánica.
- Solubilizar:
- Transformar químicamente una sustancia de tal modo de que pase de soluble (que se puede disolver) a insoluble (que no se puede disolver) para un solvente dado.
- Sublimar:
- Proceso químico mediante el cual se modifica el estado sólido de un material por el de estado gaseoso.
- Sumidero:
- Lugar en el que el agua desaparece bajo tierra en una región calcárea. Agujero o abertura en el fondo o en el costado de una depresión en una zona kárstica, por la que una corriente de agua de superficie o un lago fluye hacia un acuífero y desaparece parcial o totalmente.
- Sustentabilidad:
- Equilibrio en la relación uso por parte del hombre, de los elementos que nos brinda la naturaleza. Es la capacidad que tiene una sociedad para hacer un uso consciente y responsable de sus recursos, sin agotarlos o exceder su capacidad de renovación, y sin comprometer el acceso a estos por parte de las generaciones futuras.
- Teratogénicos:
- Estudio de las anomalías y deformaciones congénitas del organismo vegetal o animal.
- Terraplén:
- Desnivel con una cierta pendiente. Obra construida para retener el flujo de agua de un río dentro de un tramo determinado de su cauce o para prevenir inundaciones debidas a mareas u ondas.
- Tifón:
- Ciclón que se origina sobre las aguas tropicales o subtropicales y presenta una convección organizada y una circulación ciclónica caracterizada por el viento de superficie.
- Tributario:
- Curso de agua que desemboca en uno mayor o en un lago. Sinónimo: afluente.
- Tundra:
- Terreno abierto y llano, de clima subglacial y subsuelo helado, carente de vegetación arbórea, con el suelo cubierto de musgos y líquenes, pantanoso en su mayor parte. Se extiende por las costas bajas de Rusia, Siberia y América del Norte.
- Turba:
- Carbón fósil formado de residuos vegetales, de color pardo oscuro, aspecto terroso y poco peso.
- Turbina bomba resistible:
- Son turbo máquinas reversibles, tanto generatrices como motrices, utilizados en centrales eléctricas que ejecutan una serie de funciones, entre otras las de acumulación por bombeo.
- Turbina tipo Francis:
- Motor hidráulico de reacción, es radial centrípeta, con tubo de aspiración. Se emplea en las centrales hidráulicas con saltos de pequeña y mediana altura.
- Turbina tipo Kaplan:
- Es un tipo de turbina de agua que basa su funcionamiento en un rodete que viene a realizar una función de manera similar que la hélice de una embarcación. Se utiliza en pequeños saltos hidráulicos con grandes caudales.
- UNDESA:
- División de Naciones Unidas de Asuntos Económicos y Sociales.
- UNESCO:
- Organización de las Naciones Unidas para la Educación, la Ciencia y la Cultura.
- UNICEF:
- Fondo de las Naciones Unidas para la Infancia.
- Vega:
- Terreno bajo, llano y fértil.
- Ventisquero:
- Sitio en las altura de los montes, donde se conserva la nieve y el hielo. Masa de nieve o hielo reunida en ese sitio.
- WPI:
- Índice de Pobreza del Agua (por su sigla en inglés).
- WWAP:
- Programa Mundial de Evaluación de los Recursos Hídricos de las Naciones Unidas.
- WWDR:
- Informe sobre el desarrollo de los recursos hídricos en el mundo.
- Zona deprimida:
- Depresión de carácter local en el lecho del cauce o en la llanura de inundación causada por el flujo de agua.
- Zona vadosa:
- Zona del subsuelo situada por encima del nivel freático en la que los huecos están llenos de aire y agua, y la presión del agua es menor que la presión atmosférica.
- Zooplancton:
- Conjunto de organismos animales y vegetales, generalmente diminutos, que flotan y son desplazados pasivamente en aguas saladas o dulces.



















